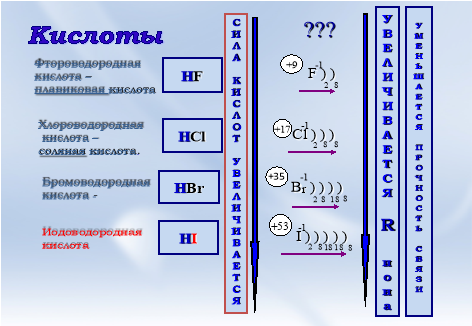
Как изменяется сила галогеноводородных кислот в ряду hf-hcl-hbr-hi почему

Конспект урока: Соединения галогенов
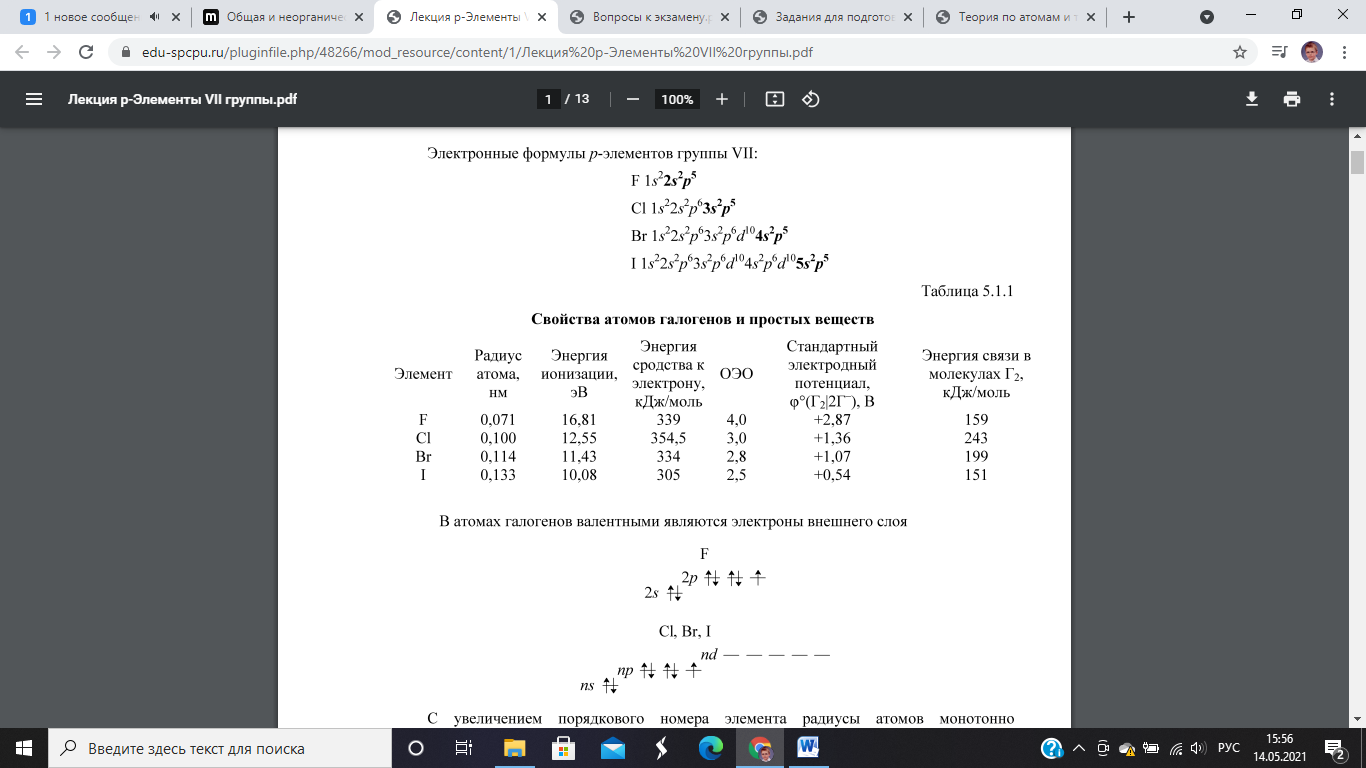
Сила бинарных бескислородных кислот, т. Для галогеноводородных кислот в ряду HF - НС1 - НВr - HI сила кислот увеличивается, в то время как электроотрицательность галогена убывает, о чем свидетельствуют данные табл. Вероятно, электроотрицательность не является единственным фактором, определяющим силу бескислородных кислот. Другими факторами являются:.


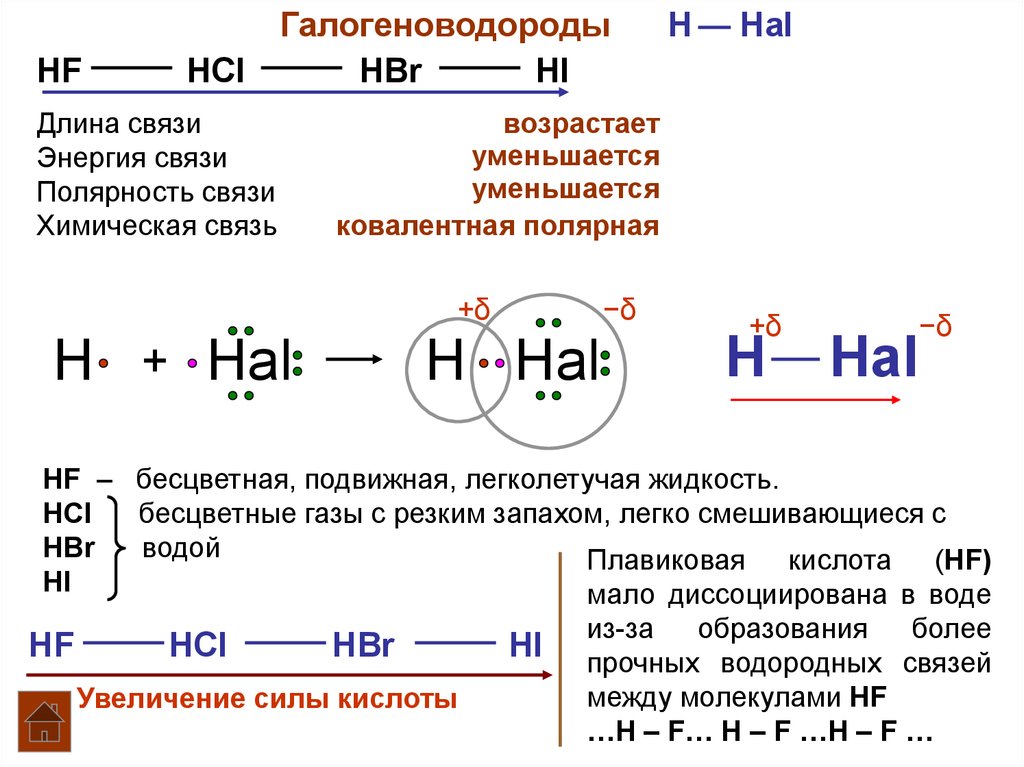



Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках. Физические свойства галогеноводородов. Это бесцветные газы с резким запахом, хорошо растворимые в воде.
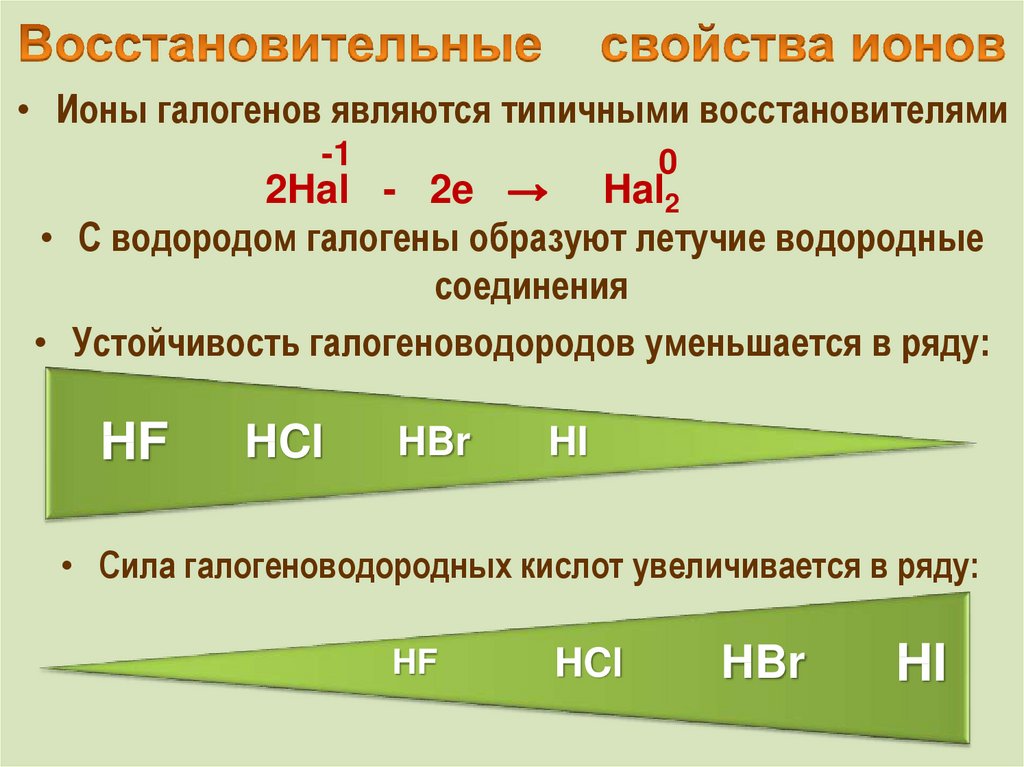
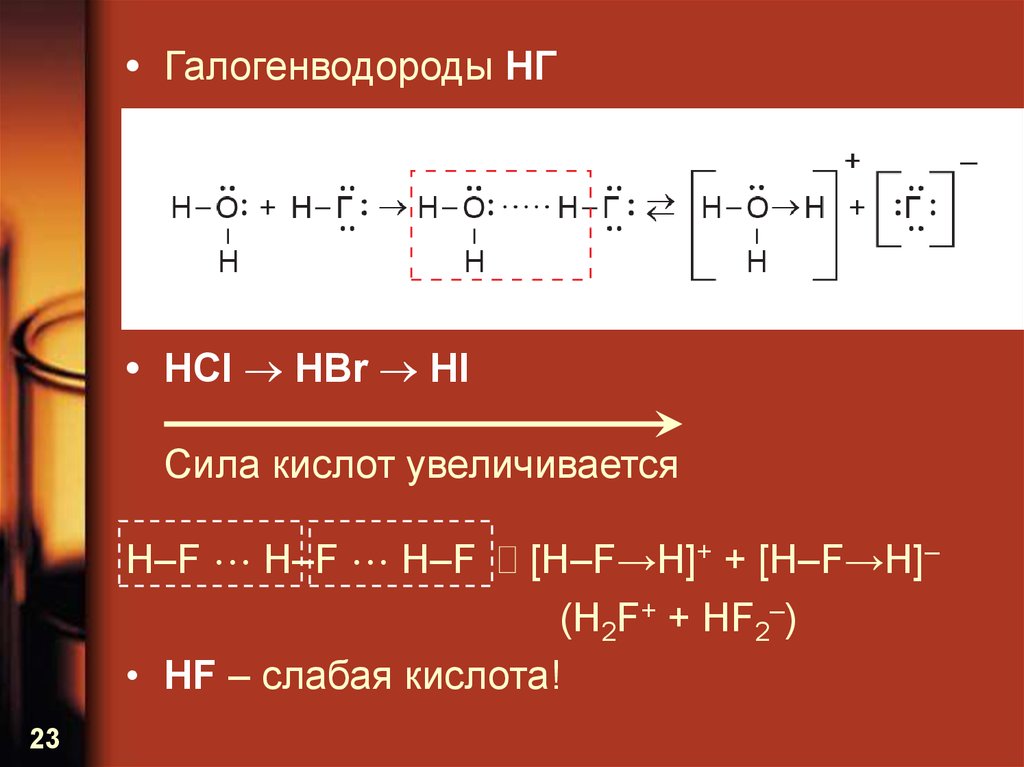

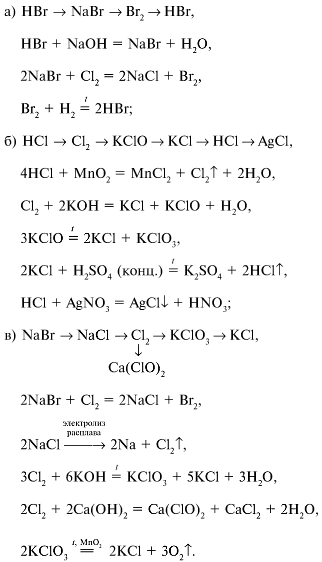




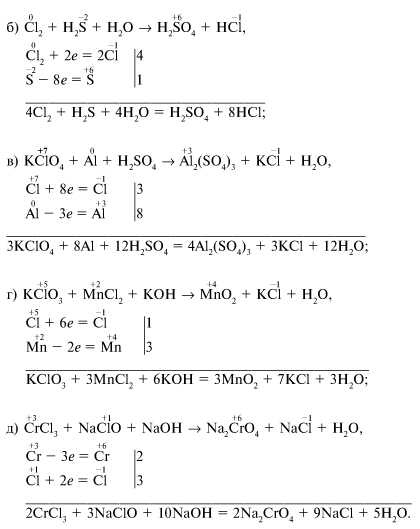
Галогеноводороды НХ - соединения с полярной связью. Электронная пара, осуществляющая химическую связь Н-X, сильно сдвинута в сторону более электроотрицательного элемента - галогена. Поэтому можно условно принять, что в галогеноводородах атом галогена имеет завершенную восьмиэлектронную конфигурацию.


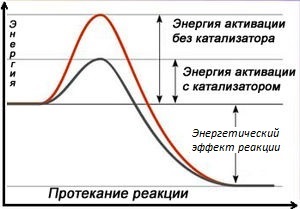





Похожие статьи
- Осенние букеты искусственные своими руками - Клубничная вертикальная грядка своими руками
- Почему ты не со мной почему текст колдун
- Простые инкубаторы для перепелов своими руками - Красная лампа обогрева - провокация беспорядков в к
- Цепочек золотых плетение нонна - 20 видов плетения золотых цепочек и других украшений